Carbohidratos
 Los carbohidratos (también
llamados sacáridos), con base en su masa, son la clase más abundante de
moléculas biológicas en la Tierra.
Los carbohidratos (también
llamados sacáridos), con base en su masa, son la clase más abundante de
moléculas biológicas en la Tierra.
El nombre carbohidrato,
“hidrato de carbono”, indica que su fórmula empírica es (CH2O)n, donde n
es 3 o más (en general n es 5 o 6, pero puede ser hasta 9).
Se pueden describir los
carbohidratos por la cantidad de unidades monómeras que contienen.
Los monosacáridos son las unidades más
pequeñas de estructura de carbohidratos.

Los monosacáridos son sólidos blancos, cristalinos y solubles en agua que tienen sabor dulce. Entre los ejemplos están la glucosa y la fructosa. Desde el punto de vista químico, los monosacáridos son polihidroxi aldehídos o aldosas, o polihidroxi cetonas o cetosas .Se clasifican por el tipo de grupo carbonilo y por la cantidad de átomos de carbono.Como regla, se usa el sufijo -osa para dar nombre a los carbohidratos, aunque hay varia excepciones. Todos los monosacáridos tienen al menos tres átomos de carbono.
Los monosacáridos más
pequeños son triosas, azúcares con tres carbonos.
Los oligosacáridos son polímeros con dos hasta unos 20 residuos de monosacárido. Los oligosacáridos más comunes son los disacáridos, formados por dos residuos de monosacárido unidos.
Los polisacáridos son
polímeros que contienen muchos (en general más de 20) residuos de monosacárido.
Los oligosacáridos y los polisacáridos no tienen la fórmula empírica (CH2O)n,
porque durante la formación del polímero se elimina agua. El término glucano
(o glicano) es uno más general que se usa para los carbohidratos
polímeros. Puede indicar un polímero de azúcares idénticos (homoglicano) o de
distintos azúcares (heteroglicano).
heteroglicano).
Con frecuencia se divide a
los polisacáridos en dos clases extensas. Los homoglicanos (u
homopolisacáridos) son polímeros que sólo contienen residuos de un tipo de
monosacárido.
Los heteroglicanos (o
heteropolisacáridos) son polímeros que contienen
residuos de más de un tipo
de monosacárido.
La
mayor parte de los polisacáridos también se pueden clasificar de acuerdo con
sus funciones biológicas. Por ejemplo, el almidón y el glucógeno
son polisacáridos de almacenamiento, y la celulosa y la quitina son polisacáridos
estructurales.
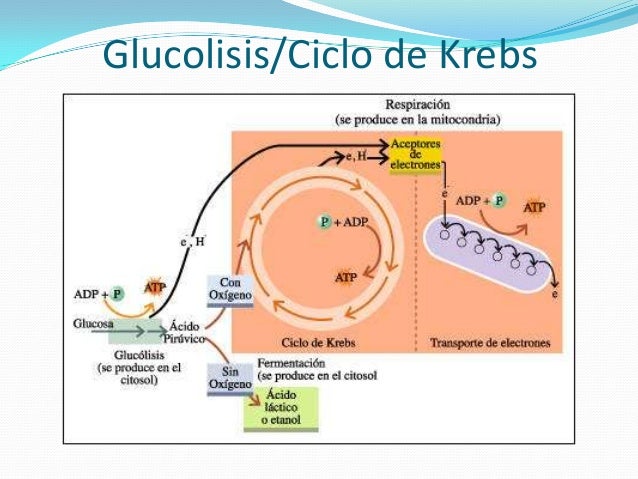
Almidón y glucógeno

Todas las especies
sintetizan D-glucosa. El exceso de glucosa se puede descomponer y producir
energía metabólica. Los residuos de glucosa se almacenan como polisacáridos, hasta
que se necesitan para producir energía. El homoglicano de almacenamiento más
común de la glucosa en las plantas y los hongos es el almidón; y en los
animales es el glucógeno. Ambos tipos de polisacárido existen en las bacterias.
 El manitol es un diurético osmótico parenteral. Se utiliza para reducir la presión intracraneal, el edema cerebral, y la presión intraocular, y para promover la diuresis en la prevención y/o tratamiento de la oliguria en pacientes con insuficiencia renal aguda. Se utiliza como una medida adicional en el tratamiento de apoyo del edema de diversos orígenes. El manitol también se usa solo o en combinación con otros agentes diuréticos para promover la excreción urinaria de tóxicos tales como salicilatos, barbitúricos, litio, y bromuros.
El manitol es un diurético osmótico parenteral. Se utiliza para reducir la presión intracraneal, el edema cerebral, y la presión intraocular, y para promover la diuresis en la prevención y/o tratamiento de la oliguria en pacientes con insuficiencia renal aguda. Se utiliza como una medida adicional en el tratamiento de apoyo del edema de diversos orígenes. El manitol también se usa solo o en combinación con otros agentes diuréticos para promover la excreción urinaria de tóxicos tales como salicilatos, barbitúricos, litio, y bromuros.
Mecanismo de acción: sistémicamente, manitol eleva la osmolalidad de la sangre, lo que aumenta el gradiente osmótico entre la sangre y los tejidos, facilitando de este modo el flujo de fluido fuera de los tejidos, incluyendo el cerebro y el ojo, así como en el líquido intersticial y la sangre. Esta actividad reduce el edema cerebral, la presión intracraneal, la presión del líquido cefalorraquídeo, y la presión intraocular. La reabsorción de manitol por el riñón es mínima, por lo que la presión osmótica del filtrado aumenta, inhibiendo la reabsorción de agua y solutos en el túbulo renal, y la produciendo diuresis. Esta actividad puede revertir las reducciones agudas en el flujo sanguíneo renal, la filtración glomerular tubular y el flujo de orina asociada con el trauma. Además, este efecto puede mejorar la excreción urinaria de toxinas y proteger contra la toxicidad renal mediante la prevención de la concentración de toxinas en el túbulo,aunque deben existir un suficiente flujo sanguíneo renal y la filtración glomerular tubular para que el fármaco alcance el túbulo y ejercer su efecto.
Farmacocinética: El manitol se administra por vía intravenosa, y la diuresis se produce generalmente en 1-3 horas. La disminución en la presión del líquido cefalorraquídeo se producirá en aproximadamente 15 minutos y se mantendrá durante 3-8 horas después de que finaliza la infusión. La presión intraocular elevada se puede reducir en 30-60 minutos, y el efecto puede durar entre 4-8 horas. Manitol permanece confinado en el compartimento extracelular y no parece cruzar la barrera de sangre-cerebro a menos que existan concentraciones muy altas o el paciente tenga acidosis. No se sabe si el manitol se distribuye a la leche materna. El fármaco se experimenta un mínimo metabolismo de glucógeno en el hígado. La mayor parte de la dosis se filtra libremente por los riñones, con menos del 10% de reabsorción tubular. La vida media de manitol oscila desde 15 hasta 100 minutos. En pacientes con insuficiencia renal aguda u otras condiciones que afectan a la filtración glomeruraal tubular, sin embargo, la semi-vida puede aumentar a 36 horas.
Importancia
farmacéutica de los carbohidratos
La mayoría de
los carbohidratos, sobre todo los de bajo peso molecular, son necesidades
farmacéuticas, así tenemos edulcorantes como glucosa, sorbitol y sacarosa,
diluyentes como sorbitol y glucosa liquida ,diluyentes de tabletas como lactosa, aglutinantes como almidón,desintegrantes como celulosa pulverizada .Sin embargo ,hay algunos compuestos
de este grupo ,principalmente los de alto peso molecular que tienen efectos
por lo que se utilizan en el tratamiento
de de diversas condiciones patológicas , como manitol por su efecto diurético, derivados de celulosa y agar por su efecto laxante .
FORMA FARMACEUTICA Y FORMULACION:
Cada 100 ml contienen:
Cada 100 ml contienen:
Manitol ........................................... 20 g
Agua inyectable c.b.p. ............... 100 ml
Agua inyectable c.b.p. ............... 100 ml
INDICACIONES TERAPEUTICAS: El manitol está indicado como diurético osmótico, como antiglaucomatoso (sistémico), como antihemolítico y como antídoto (de sustancias tóxicas).
DESCRIPCIONMecanismo de acción: sistémicamente, manitol eleva la osmolalidad de la sangre, lo que aumenta el gradiente osmótico entre la sangre y los tejidos, facilitando de este modo el flujo de fluido fuera de los tejidos, incluyendo el cerebro y el ojo, así como en el líquido intersticial y la sangre. Esta actividad reduce el edema cerebral, la presión intracraneal, la presión del líquido cefalorraquídeo, y la presión intraocular. La reabsorción de manitol por el riñón es mínima, por lo que la presión osmótica del filtrado aumenta, inhibiendo la reabsorción de agua y solutos en el túbulo renal, y la produciendo diuresis. Esta actividad puede revertir las reducciones agudas en el flujo sanguíneo renal, la filtración glomerular tubular y el flujo de orina asociada con el trauma. Además, este efecto puede mejorar la excreción urinaria de toxinas y proteger contra la toxicidad renal mediante la prevención de la concentración de toxinas en el túbulo,aunque deben existir un suficiente flujo sanguíneo renal y la filtración glomerular tubular para que el fármaco alcance el túbulo y ejercer su efecto.
Farmacocinética: El manitol se administra por vía intravenosa, y la diuresis se produce generalmente en 1-3 horas. La disminución en la presión del líquido cefalorraquídeo se producirá en aproximadamente 15 minutos y se mantendrá durante 3-8 horas después de que finaliza la infusión. La presión intraocular elevada se puede reducir en 30-60 minutos, y el efecto puede durar entre 4-8 horas. Manitol permanece confinado en el compartimento extracelular y no parece cruzar la barrera de sangre-cerebro a menos que existan concentraciones muy altas o el paciente tenga acidosis. No se sabe si el manitol se distribuye a la leche materna. El fármaco se experimenta un mínimo metabolismo de glucógeno en el hígado. La mayor parte de la dosis se filtra libremente por los riñones, con menos del 10% de reabsorción tubular. La vida media de manitol oscila desde 15 hasta 100 minutos. En pacientes con insuficiencia renal aguda u otras condiciones que afectan a la filtración glomeruraal tubular, sin embargo, la semi-vida puede aumentar a 36 horas.
o Anuria con necrosis tubular aguda debida a enfermedad renal severa; deshidratación severa; hemorragia intracraneal activa, excepto durante la craneotomía.
o También se contraindica en la congestión pulmonar o edema pulmonar severos. Insuficiencia cardiaca congestiva; hipovolemia; hiperpotasemia o hiponatremia y en la disfunción renal significativa.
PRECAUCIONES O RESTRICCIONES DE USO DURANTE EL EMBARAZO O LA LACTANCIA: No deberá utilizarse durante el embarazo ni la lactancia a menos que los beneficios superen con claridad los riesgos potenciales.
SORBITOL Glomed - Bebida en Polvo
INGREDIENTES
Cada paquete contiene: 5 gramos de sorbitol
INDICACIONES
El sorbitol se utiliza en el tratamiento del estreñimiento y la indigestión.
Dosificación y administración
El tratamiento de los síntomas dispépticos: antes de las comidas o cuando se utiliza con la indigestión, los adultos 1-3 paquetes al día.
Tratamiento del estreñimiento:
- Adultos: 1 paquete de utilizar por la mañana, en ayunas.
- Niños: usan la mitad de la dosis para adultos.
El sorbitol se utiliza sólo una única dosis y se utiliza con poca frecuencia en el tratamiento del estreñimiento.
Fase 1 ½ tazas envueltos en agua 10 minutos antes de las comidas.
CONTRAINDICACIONES
Enfermedades entidad enteritis, colitis - colorrectal.
la enfermedad de Crohn y síndrome de reglas o de obstrucción, síndrome de dolor abdominal de causa desconocida.
Los pacientes con intolerancia a la fructosa heredados.
Advertencias y precauciones
No utilizar en caso de congestión de la densidad, insuficiencia renal o hepática gravemente dañados.
En los pacientes con colon irritable sorbitol evitarse cuando se tiene hambre y debe reducir la dosis.
El estreñimiento por sorbitol sólo el apoyo para los tratamientos de dieta adecuada. No use laxantes a largo plazo.
EFECTOS ADVERSOS
Flatulencia, dolor abdominal y diarrea, especialmente en personas con la enfermedad del intestino irritable o distensión abdominal.
Informe a su médico acerca de cualquier efecto adverso encontradas durante el tratamiento .
INTERACCIONES
Todos los laxantes pueden acortar el tiempo de viaje de las píldoras de juntas, reduciendo de este modo la absorción de estos fármacos.
PRESENTACIÓN
Caja de 20 paquetes, paquetes de 5 gramos.
ALMACENAMIENTO: a un lugar seco, protegido de la luz, la temperatura no superior a 30 o C.
NORMAS DE CALIDAD: TCCS.
VIDA ÚTIL: 36 meses desde la fecha de fabricación.
PARA FUERA DE ALCANCE DE LOS NIÑOS
B. Celulosa y quitina
La celulosa es un
polisacárido estructural. Es uno de los principales componentes de las paredes
celulares rígidas que rodean muchas células vegetales. Los tallos y las ramas
de muchas plantas están formados principalmente por celulosa. Este solo
polisacárido forma un porcentaje apreciable de toda la materia orgánica en la
Tierra. Igual que la amilosa,la celulosa es un polímero lineal de residuos de
glucosa.
Ciclación
de aldosas y hexosas
 El comportamiento óptico de
algunos monosacáridos parece indicar que tienen un átomo de carbono más que lo
que se ve en las estructuras de las figuras . Por ejemplo, la D-glucosa tiene
dos formas que contienen cinco (no cuatro) carbonos asimétricos
El comportamiento óptico de
algunos monosacáridos parece indicar que tienen un átomo de carbono más que lo
que se ve en las estructuras de las figuras . Por ejemplo, la D-glucosa tiene
dos formas que contienen cinco (no cuatro) carbonos asimétricos
La causa de esta asimetría
adicional es una reacción de ciclación intramolecular, que produce un nuevo
centro quiral en el átomo de carbono del grupo carbonilo. Esta ciclación se
parece a la reacción de un alcohol con un aldehído para formar un hemiacetal,o
con una cetona para formar un hemicetal.
El carbono carbonílico de
una aldosa que contenga al menos cinco átomos de carbono, o de una cetosa que
contenga al menos seis átomos de carbono, puede reaccionar un grupo hidroxilo
intramolecular y formar un hemiacetal cíclico o un hemicetal cíclico,
respectivamente.
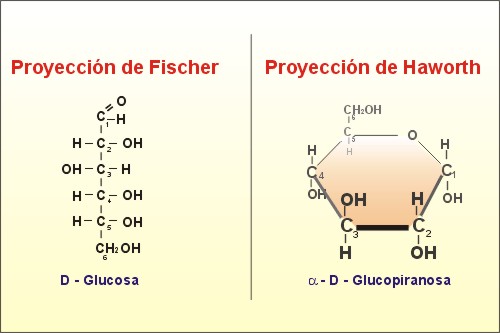
. Una proyección de Haworth
indica la estereoquímica en forma adecuada, y se puede relacionar con facilidad
con una proyección de Fischer. Un monosacárido cíclico se traza de modo que el
carbono anomérico esté en la derecha, y los demás carbonos se numeran en
dirección de las manecillas del reloj. Los grupos hidroxilo que apuntan hacia
abajo en la proyecció de Haworth, lo hacen hacia la derecha del esqueleto de
carbonos en la proyección de Fischer, en tanto que los
grupos hidroxilo que apuntan hacia arriba en la proyecciónde Haworth lo hacen
hacia la izquierda en la proyección de Fischer.
Derivados
de los monosacáridos
A. Fosfatos de azúcar
Los monosacáridos, en las
vías metabólicas, con frecuencia se convierten en ésteres de fosfato. Los
fosfatos de triosa, el 5-fosfato de ribosa y el 6-fosfato de glucosa son
ésteres alcohol-fosfato simples.
El 1-fosfato de glucosa es
un fosfato de hemiacetal, más reactivo que un fosfato de alcohol. La capacidad
de la UDP-glucosa para funcionar como donador de glucosilo es una prueba de
esta reactividad.
B.Desoxiazúcares
En esos derivados,un átomo de hidrógeno
sustituye a uno de los grupos hidroxilo del monosacárido precursor. La
2-desoxi-D-ribosa es un bloque constructivo importante en el ADN. La L-fucosa
(6-desoxi-L-galactosa) está muy distribuida en plantas, animales y
microorganismos.
A pesar de su rara
configuración L, la fucosa se deriva metabólicament de la D-manosa.
C. Aminoazúcares
En varios azúcares, un
grupo amino sustituye uno de los grupos hidroxilo del monosacárido precursor. A
veces el grupo amino está acetilado. En la figura 8.15 se ven tres ejemplos de
aminoazúcares. Los aminoazúcares de la glucosa y la galactosa se suelen presentar
en glucoconjugados. El ácido N-acetilneuramínico (NeuNAc) se forma a partir
de la N-acetilmanosamina y piruvato. Cuando este compuesto se cicla y
forma una piranosa, el grupo carbonilo en C-2 (de la mitad de piruvato)
reacciona con el grupo hidroxilo de C-6. El NeuNAc es un componente importante
de muchas glucoproteínas y de una familia de lípidos llamados gangliósidos
(sección 9.5). El ácido neuramínico y sus derivados, incluyendo el NeuNAc,
tienen el nombre colectivo de ácidos siálicos.