Propiedades de las enzimas
Las enzimas son catalizadores biológicos selectivos de
una eficiencia extraordinaria.
Un catalizador es una sustancia que acelera la llegada a
un equilibrio. Un catalizador puede cambiar en forma temporal durante la
reacción, pero no cambia en el proceso general, porque se recicla para
participar en varias reacciones. las enzimas actúan como catalizadores.
Estas enzimas catalizan las reacciones de las rutas
metabólicas centrales, necesarias para mantener la vida.
El papel principal de las enzimas es aumentar las
velocidades de las reacciones. En forma
típica, las reacciones catalizadas por las enzimas son de 103 a 1020
veces más rápidas que las mismas sin catalizar.
Entonces
podemos generalizar las propiedades de las enzimas:
AUMENTAN LA VELOCIDAD DE REACCIÓN
–De 103
to 1020veces vs sin enzima.
–Aún más rápido
que los catalizadores químicos.
•CONDICIONES DE
REACCIÓN
–pH neutro
(5-9), la mayoría 6.5 –7.5
–Presión
atmosférica normal
•CAPACIDAD DE REGULACIÓN
–Por
concentración de sustrato
–Por
concentración de enzima
–Por inhibidores
competitivos (semejantes al sustrato)
–Por inhibidores
no competitivos (modificación covalente de la enzima)
–Por regulación
alostérica
•ALTA ESPECIFICIDAD DE REACCIÓN
–Interacción
estereoespecífica con el sustrato
–No hay
productos colaterales
Las
cuatro propiedades principales de las enzimas: 1) pueden desempeñarse como
catalizadores, 2) catalizan reacciones muy específicas, 3) pueden acoplar
reacciones y 4) su actividad puede ser regulada.
Hay dos características importantes en la
catálisis
1.-Las enzimas aumentan la velocidad de la
reacción sin verse alteradas en el proceso, no se modificanen su actuación: E +
S--------ES-------------E + P
2.-Las enzimas no modifican la constante de
equilibrio de la reacción.
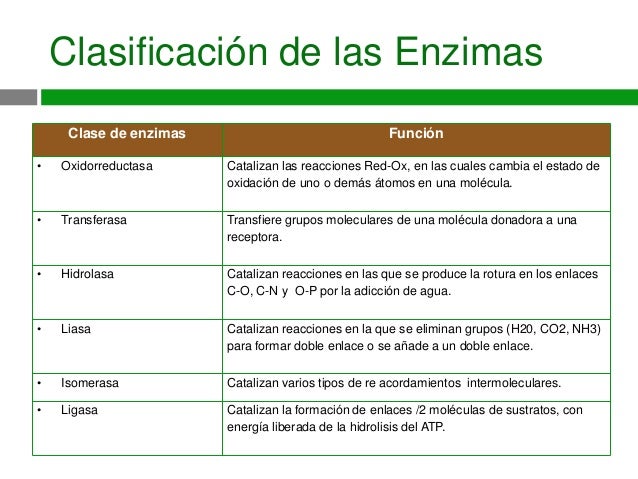
Un comité de la Unión Internacional de Bioquímica y
Biología Molecular (IUBMB, de International Union of Biochemistry and Molecular
Biology) mantiene un esquema de clasificación que asigna categorías a las
enzimas de acuerdo con la clase general de reacción química orgánica que es
catalizada. Las seis categorías son: oxidorreductasas, transferasas,
hidrolasas, liasas, isomerasas y ligasas.
Consta actualmente de 3 partes:
•el sustrato preferente
•el tipo de reacción realizada
•terminación "asa"
Ejemplo: Identificación EC 5.3.1.1.
Nombre sistemático Triosa fosfato isomerasa
Donde: EC 5.3.1.1.
- EC: enzima clasificación
- Primer digito representa la clase
- Segundo digito significa la subclase
- Tercer digito es la subsubclase o subgrupo
Factores que afectan la actividad de la
Enzima
•pH •Temperatura •[Enzima]
•[Sustrato] •Inhibidores
CINÉTICA ENZIMÁTICA
TEORÍAS PROPUESTAS PARA EXPLICAR LA ACCIÓN
ENZIMÁTICA
1894 Fischer propuso la hipótesis de la
llave-cerradura

1958
Koshland propuso el modelo del ajuste inducido
Las reacciones enzimáticas se
ajustan a dos tipos de cinéticas, que son:
•Hipérbolas
rectangulares: enzimas que
siguen la cinética de Michaelis-Menten
•Sigmoidales:
enzimas alostéricas que muestran fenómenos de cooperatividad

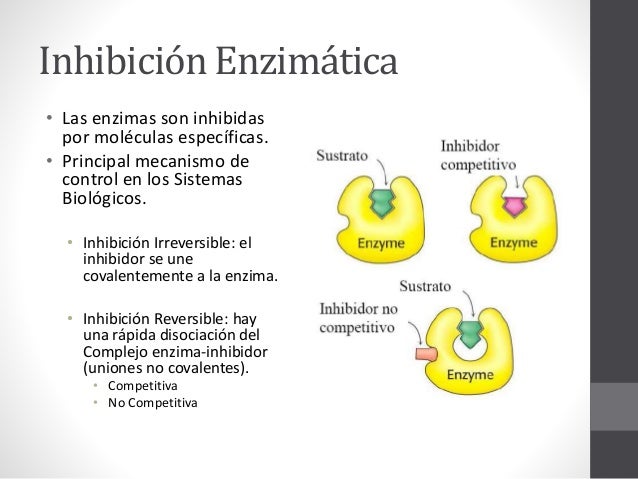
Los tipos básicos de inhibición reversible son:
 En
la inhibición competitiva, el inhibidor sólo se puede unir a
moléculas de enzima libre que no estén unidas a sustrato alguno.
En
la inhibición competitiva, el inhibidor sólo se puede unir a
moléculas de enzima libre que no estén unidas a sustrato alguno.
Cuando un inhibidor competitivo se une con una molécula
de enzima, una molécula de sustrato no puede unirse a esa molécula de enzima.
Al revés, la unión de sustrato y una molécula de enzima evita el enlazamiento
de un inhibidor. En otras palabras, S e I compiten por unirse a la molécula de
enzima.
En
la inhibición acompetitiva disminuye la Vmáx (aumenta 1/Vmáx) por
conversión de algunas moléculas de E en la forma inactiva ESI. Ya que es el
complejo ES el que se enlaza con I y la disminución de Vmáx no se revierte por
la adición de más sustrato.
También, los
inhibidores acompetitivos hacen descender la Km (vista como un aumento del
valor absoluto de 1/Km en una gráfica de doble recíproco) ya que los
equilibrios de formación de ES y de ESI son desplazados hacia los complejos,
por la unión de I.
Inhibición no competitiva
Los inhibidores no competitivos se pueden unir a la E o
al ES y formar complejos inactivos EI o ESI, respectivamente.
Esos inhibidores no son análogos del sustrato y no se
enlazan en el mismo sitio que el S. El caso clásico de inhibición no
competitiva se caracteriza por una disminución aparente de Vmáx (1/Vmáx parece
aumentar) sin cambiar de la Km.
Un inhibidor enzimático irreversible forma un enlace
covalente estable con una molécula de enzima y elimina así las moléculas del
sitio activo en la población enzimática. Típicamente, la inhibición
irreversible ocurre por alquilación o acilación de la cadena lateral de un
residuo de aminoácido en el sitio activo.

Enzimas alostéricas
Las enzimas alostéricas son
enzimas cuyas propiedades son afectadas por cambios en la estructura. Los cambios
estructurales son ocasionados por interacción con moléculas pequeñas.

Las acciones farmacológicas de diversos fármacos dependen en
realidad de la interacción enzima-fármaco, ejemplos: inhibidores de MAO,
alopurinol, aspirina. Por lo tanto, un conocimiento de las enzimas y sus
propiedades y sus propiedades es de suma importancia para el farmacéutico con
el fin de comprender el mecanismo de acción de los medicamentos.
Además, las enzimas tienen importancia tanto en el diagnóstico
como en el tratamiento de enfermedades.
ejemplo

Pancreolipasa
Panzytrat Ok ® contiene pancreatina (mezcla de enzimas pancreáticas), para el tratamiento de los trastornos de la digestión debido a una insuficiencia exocrina del páncreas.
Panzytrat Ok ® es un moderno medicamento que sigue el principio de la dosis de unidades múltiples. Al contrario de la dosis de unidad única (tabletas o grageas), una cuchara dosificadora se compone de muchas microtabletas gastrorresistentes que están recubiertas por una capa de gelatina dura, absolutamente idénticas en tamaño, forma, grosor y contenido.
Panzytrat Ok ® luego de la administración de las microtabletas se mezclan con el contenido gástrico y llegan al duodeno donde ejercen su acción; de este modo se logra la disponibilidad casi fisiológica de las enzimas pancreáticas digestivas, especialmente de lipasa, a nivel del intestino delgado.
DESCRIPCION
La pancreatina es un extracto de las glándulas pancreáticas
porcinas que contiene múltiples enzimas, en particular lipasas, proteasas y
amilasas. Se utiliza en el tratamiento de la insuficiencia pancreática.
Mecanismo de acción: Las enzimas pancreáticas de la
pancreatina catalizan la hidrólisis de las grasas de los ácidos grasos
monoglicéridos, glicerol ylibres, proteínas en péptidos y aminoácidos, y los
almidones en dextrinas y azúcares de cadena corta, tales como maltosa y
maltriosa en el duodeno y el intestino delgado proximal, actuando de este modo
como las enzimas digestivas fisiológicamente secretada por el páncreas.
Farmacocinética: las enzimas pancreáticas de la pancreatina
están recubiertas por una cubierta entérica para reducir al máximo la
destrucción o inactivación de las mismas por los ácidos gástricos. La
pancrelipasa está diseñada para liberar la mayoría de las enzimas a un pH
aproximado de 5.5 o mayor. Las enzimas pancreáticas no son absorbidos desde el
tracto gastrointestinal en cantidades apreciables y ejercen sus efectos
localmente en el intestino.
La bromelaina es extraída de la planta y del fruto de la piña tropical. La Bromelaina es una proteasa que se emplea en las industrias alimentaria y farmacéutica. La bromelaína de los frutos es una proteasa ácida, su intensa actividad proteolítica no se modifica en zonas de pH entre 3 y 8. Esta biomolécula se utiliza en las industrias alimentarias en varios procesos proteolíticos, (por ejemplo como ablandadora de carnes), complemento alimenticio y en la industria farmacéutica.
La Bromelaìna gracias a su actividad proteolitica ayuda a digerir las proteínas descomponiéndolas en aminoácidos. Las enzimas proteolíticas ayudan a la digestión de los alimentos evitando la pesadez de estómago y ayudando al tratamiento de la pancreatitis. Además de las propiedades digestivas atribuidas a la bromelina se le conocen propiedadesantiinflamatorias, antiedematosas, antitrombóticas, anticancerígenas y fibrinolíticas.
Se cree que cuando se ingiere con el estómago vacío actúan sus propiedades como agente antiinflamatorio. Con respecto a la actividad antiinflamatoria de la Bromelaína, según los servicios de salud de la Biblioteca Nacional de Medicina y los Institutos Nacionales de Salud de los EE.UU, sólo existen evidencias científicas significativas sobre los procesos inflamatorios contra la sinusitis.
Propiedades:
- Anti-inflamatoria
- Proteolítica
- Ayuda a la digestión de las proteinas






No hay comentarios:
Publicar un comentario