Mecanismos de las enzimas
El mecanismo de una reacción
es una descripción detallada de los eventos moleculares atómicos e incluso
subatómicos que suceden durante la reacción. Deben identificarse los reactivos,
los productos y todos los compuestos intermedios.
Los mecanismos enzimáticos se
representan con el mismo simbolismo que el usado en química orgánica para
representar la ruptura y la formación de enlaces químicos. El movimiento de los
electrones es la clave para comprender las reacciones químicas (y enzimáticas).
A.
Sustituciones nucleofílicas
Hay dos tipos
de intermedios iónicos: unas especies son ricas en electrones o nucleofílicas,
y otras especies son pobres en electrones, o electrofílicas. Por ejemplo, la transferencia de
un grupo acilo se puede representar con el mecanismo general siguiente:

Otro tipo de sustitución nucleofílica consiste en el
desplazamiento directo. En este mecanismo, el grupo o molécula atacante se
adiciona a la cara del átomo central, opuesto al grupo saliente, y forma un
estado de transición que tiene cinco grupos asociados al átomo central. Este estado
de transición es inestable y de gran energía
A.
Reacciones de ruptura
romper de dos maneras: dos electrones
permanecen con un átomo, o un electrón puede permanecer con
cada átomo
enlazado.
A.
Reacciones de oxido-reducción
Oxidación
es
la pérdida de electrones:una sustancia que es oxidada tendrá menos electrones
cuando se termine la reacción.
La reducción
es la ganancia de electrones: una sustancia que gana electrones en una
reacción es reducida.
Las reacciones de oxidación
y reducción siempre suceden en forma simultánea.
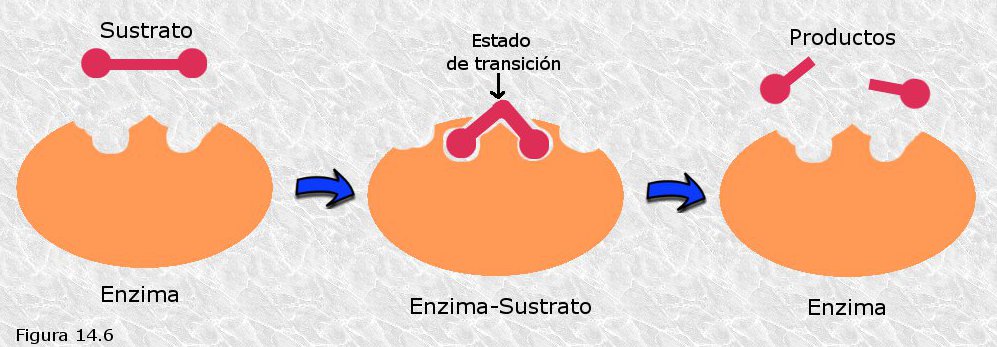
Estabilización
de estados de transición mediante catalizadores
 Diagrama
de energía para una reacción que tiene un compuesto intermedio. Este compuesto intermedio
está en el mínimo entre los dos estados de transición. El paso que determina la
velocidad en dirección de avance es la formación del primer estado de
transición, que es el que tiene mayor energía de transición. S representa al
sustrato y P representa al producto
Diagrama
de energía para una reacción que tiene un compuesto intermedio. Este compuesto intermedio
está en el mínimo entre los dos estados de transición. El paso que determina la
velocidad en dirección de avance es la formación del primer estado de
transición, que es el que tiene mayor energía de transición. S representa al
sustrato y P representa al producto
Modos
químicos de la catálisis enzimática
La formación de un complejo ES coloca a los reactivos en
la cercanía de residuos de aminoácidos del sitio activo de la enzima. Las
cadenas laterales ionizables participan
en dos clases de catálisis química:
catálisis ácido-base y catálisis covalente. Son los dos modos químicos principales de catálisis.
Residuos polares de aminoácidos en
sitios activos
La cavidad del sitio activo
en una enzima en general está cubierta con residuos hidrofóbicos de
aminoácidos. Sin embargo, también en el sitio activo hay unos pocos residuos
polares, ionizables (con algunas moléculas de agua). Los residuos polares de
aminoácidos (o a veces coenzimas) tienen cambios químicos durante la catálisis
enzimática. Esos residuos forman gran parte del centro catalítico de la enzima.


A.
Influencia del pH sobre las velocidades
de reacción enzimática
El efecto del pH sobre la
velocidad de reacción de una enzima puede indicar cuáles residuos ionizables de
aminoácido están en su sitio activo. La sensibilidad al pH suele reflejar una
alteración en el estado de ionización de uno o más residuos que participan en
la catálisis, aunque a veces se afecta la unión con el sustrato.
Reacciones controladas por difusión
Una reacción que se produce
con cada choque entre moléculas de reactivos se llama reacción controlada por
difusión. Bajo condiciones fisiológicas, se ha calculado que la velocidad
controlada por difusiones es de 108 a 109 M–1
s–1. La frecuencia de encuentros puede ser mayor si hay atracción electrostática
entre los reactivos.
La triosa fosfato isomerasa
cataliza la interconversión rápida de la dihidroxiacetona fosfato (DHAP) y el
gliceraldehído 3-fosfato(G3P) en las rutas de la glicólisis y la
gluconeogénesis.
Superóxido dismutasa
La superóxido dismutasa es un
catalizador todavía más rápido que la triosa fosfato isomerasa.
La
superóxido dismutasa cataliza la eliminación, muy rápida, del radical
aniónsuperóxido, •O2_, que es un subproducto del
metabolismo oxidante. La enzima cataliza la conversión de superóxido en oxígeno
molecular y peróxido de hidrógeno, el cual se limina con rapidez por la acción
subsecuente de enzimas, como la catalasa.
La lisozima cataliza la
hidrólisis de algunos polisacáridos, en especial los que forman las paredes celulares
de las bacterias.
Lucky Club casino site - luckyclub.live
ResponderEliminarLucky Club is one of the biggest and most popular online casinos in the world. The site gives you a chance luckyclub to enjoy casino games from a wide variety of